इथनॉल और एथोनिक एसिड के बीच का अंतर
प्रमुख अंतर - इथनोल बनाम एथोनिक एसिड
हालांकि इथेनॉल और एथोनीक एसिड के समान नाम हैं, उनके बीच एक महत्वपूर्ण अंतर देखा जा सकता है क्योंकि वे दो अलग-अलग जैविक यौगिक हैं जिनमें दो अलग-अलग कार्यात्मक समूहों एथानोल शराबी परिवार का दूसरा सबसे सरल सदस्य है जबकि एथोनिक एसिड कार्बोक्जिलिक एसिड समूह का दूसरा सबसे सरल सदस्य है। दोनों में अणु में मौजूद कार्यात्मक समूह के अलावा केवल दो कार्बन परमाणु होते हैं जब हम उनके रासायनिक गुणों की तुलना करते हैं; उन दोनों को कार्बनिक सॉल्वैंट्स के रूप में उपयोग किया जाता है और एक विशेषता गंध होती है इसके विपरीत, एथानिक एसिड इथेनॉल से अधिक अम्लीय है
क्याहै इथेनॉल ? इथेनॉल का सामान्य नाम एथिल अल्कोहल है। इसका कार्यात्मक समूह हाइड्रॉक्सिल समूह (-ओएच समूह) है। सभी रासायनिक गुण जैसे कि प्रतिक्रिया, अम्लता या बेसिकता कार्यात्मक समूह पर निर्भर करते हैं। इथेनॉल की बहुत हल्का गंध है, और यह एक अस्थिर यौगिक है। इथेनॉल अपने औद्योगिक अनुप्रयोगों में बहुत महत्वपूर्ण है; यह एक सुरक्षित विलायक, एक ईंधन स्रोत है, जो दवाइयों और सौंदर्य प्रसाधनों का उत्पादन करती है और यह मादक पेय में मुख्य घटक है। मकई, गन्ना या घास जैसे कृषि कचरे का उपयोग करके घरेलू तौर पर इथेनॉल का उत्पादन किया जा सकता है।
-2 -> क्या है

एसिड ? एटोनिक एसिड का सबसे अधिक इस्तेमाल किया जाने वाला नाम एसिटिक एसिड है यह एक रंगहीन तरल है जो कि एक विशिष्ट खट्टे स्वाद और तीखा गंध के साथ है। इसमें सीएच 3 कॉओएच का आण्विक सूत्र है एथोनिक एसिड के निरूपित रूप को "हिमनदों एसिटिक एसिड" कहा जाता है और लगभग 3- 9% एसिड मात्रा से सिरका बना देता है एथोनिक एसिड को कमजोर एसिड के रूप में माना जाता है; लेकिन, यह संक्षारक और त्वचा पर हमला करने में सक्षम है
इथनोल और एथोनी एसिड के बीच क्या अंतर है? इथनॉल और एथोनिक एसिड के लक्षण: कार्यात्मक समूह: एथनॉल: हाइड्रोक्सिल समूह (-ओएच समूह) एथेनॉल में कार्यात्मक समूह है। यह अल्कोहल की विशेषता संपत्ति है सभी अल्कोहल में उनके संरचना में कम से कम एक -एचएच समूह है
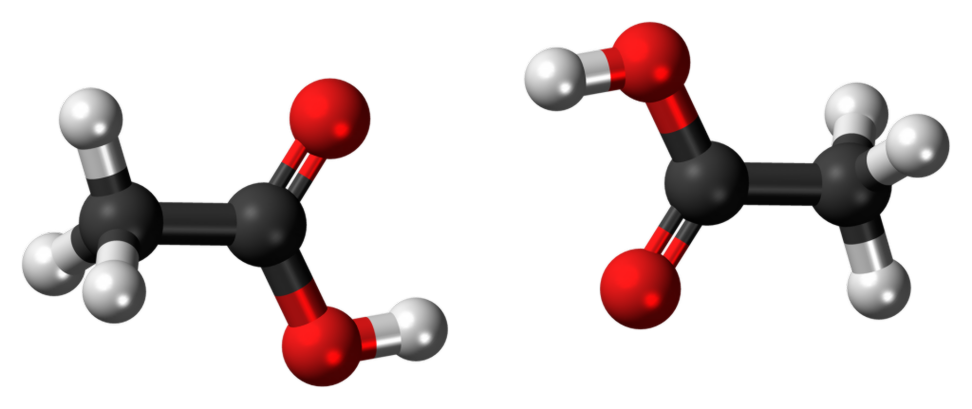
एथॉनिक एसिड में कार्यात्मक समूह एक -क्यूओएच समूह है। यह सभी कार्बोक्जिलिक एसिड के लिए सामान्य है।
गुण:
एथनॉल:
एथेनॉल एक मोनोहाइड्रिक अल्कोहल है जो मिठाई की गंध के साथ 78 डिग्री है। 5 डिग्री सेल्सियस यह केवल हाइड्रोकार्बन है जो सभी अनुपातों में पानी में घुल जाता है।ईथेनॉल एथनोनिक एसिड देने के लिए क्षारीय केएमएनओ 4 से प्रतिक्रिया करता है जबकि एथानोइक एसिड क्षारीय के एमएनओ 4 के साथ प्रतिक्रिया नहीं करता है। एथोनिक एसिड:
यह जलीय समाधान (पीकेए = 4। 76) में कमजोर मोनोप्रोटिक एसिड है। तरल एसिटिक एसिड पानी की तरह एक ध्रुवीय विलायक है। यह ध्रुवीय तरल पदार्थ जैसे कि शर्करा और लवण, और गैर-ध्रुवीय तरल पदार्थ जैसे कि तेलों और सल्फर और आयोडीन जैसे तत्वों को घुलित करता है। यह पानी के क्लोरोफॉर्म के साथ आसानी से और पूरी तरह मिटकेबल है, और हेक्सेन। एसिटिक एसिड में एक मजबूत तीखी गंध है उपयोग:
एथनॉल:
एथनॉल शराबी पेय में मौजूद है और कारों के लिए जैव ईंधन के रूप में भी इस्तेमाल किया जाता है। यह एक अच्छा विलायक है जो पानी में अघुलनशील कई कार्बनिक समाधान को भंग कर सकता है। इथनॉल का उपयोग पेंट उद्योग में कई इत्र, सौंदर्य प्रसाधन और वार्निश के निर्माण के लिए किया जाता है। ईंधन के रूप में इथेनॉल:
सीएच 3
सीएच
2 ओएच +3 ओ
2
→ 2CO 2 + 3 एच 2 ओ एथोनिक एसिड: एसिटिक एसिड को अन्य रसायनों के उत्पादन के लिए रासायनिक अभिकर्मक के रूप में उपयोग किया जाता है। इसका उपयोग विनील एसीटेट मोनोमर बनाने के लिए बड़ी मात्रा में किया जाता है; विनील एसीटेट पॉलीविनाल क्लोराइड या अन्य पॉलिमर का उत्पादन करने के लिए बहुलक किया जा सकता है। इसके अलावा, एसिटिक एसिड का उपयोग एस्टर, पेंटिंग्स और कोटिंग्स में उपयोग किए जाने वाले एस्टर का उत्पादन करने के लिए किया जाता है। एसिटिक एनहाइड्राइड एक और महत्वपूर्ण रासायनिक अवयव है जिसे एसिटिक एसिड के दो अणुओं को संघनित करके संश्लेषित किया जा सकता है। घरेलू सिनार का उत्पादन करने के लिए एथोनिक एसिड की एक छोटी मात्रा का उपयोग किया जाता है अम्लता: एथनॉल: एथनोल न सोडियम बाइकार्बोनेट (नाहको) के साथ न तो प्रतिक्रिया करता है और न ही नीली लिटमस पेपर का रंग बदलता है इसलिए, यह ईटोनिक एसिड की तुलना में कम अम्लीय है। एथोनिक एसिड:
एथोनीक एसिड एक कमजोर एसिड होता है जो सोडियम बाइकार्बोनेट (नाहको) से सीओ 2 गैस जारी करता है। इसके अलावा, यह नीला लिटमस को लाल रंग में बदल देता है छवि सौजन्य: "एथनॉल-3 डी-बॉल्स" (सार्वजनिक डोमेन) विकिमीडिया कॉमन्स के माध्यम से "एसिटिक एसिड डिमर 3 डी बॉल" जेनटो (टॉक) द्वारा - खुद का काम (सीसी0) विकिमीडिया कॉमन्स के माध्यम से



