आयनिक और सहसंयोजक यौगिकों के बीच का अंतर
मुख्य अंतर - आयनिक बनाम सहसंयोजक यौगिकों
कई अंतर उनके मैक्रोस्कोपिक गुणों जैसे ईओण और सहसंयोजक यौगिकों के बीच ध्यान में रखे जा सकते हैं जैसे कि घुलनशीलता पानी, बिजली चालकता, पिघलने के अंक और उबलते अंक। इन अंतरों का मुख्य कारण उनके संबंध पैटर्न में अंतर है इसलिए, उनके संबंध पैटर्न को ईओनिक और सहसंयोजक यौगिकों के बीच के महत्वपूर्ण अंतर के रूप में माना जा सकता है (आयनिक और सहसंयोजक बांड के बीच का अंतर) जब ईओणिक बंधन बनते हैं, तो इलेक्ट्रॉन (धातुएं) एक धातु द्वारा दान कर देते हैं और दान किए गए इलेक्ट्रॉनों को गैर धातु द्वारा स्वीकार किया जाता है। इलेक्ट्रोस्टैटिक आकर्षण के कारण वे मजबूत बंधन बनाते हैं। सहकारिता बांड दो गैर धातुओं के बीच बनते हैं सहसंयोजक संबंध में, ओक्टेट नियम को पूरा करने के लिए दो या दो से अधिक परमाणु इलेक्ट्रॉनों का हिस्सा होते हैं। आम तौर पर, आयनिक बंधन सहसंयोजक बंधन से अधिक मजबूत होते हैं। इससे उनके भौतिक गुणों में अंतर हो जाता है।
आयनिक यौगिक क्या हैं?आयनिक बंधन तब बनते हैं जब दो अणुओं को उनके इलेक्ट्रोलेगेटिव वैल्यू में बड़ा अंतर होता है। बांड बनाने की प्रक्रिया में, कम इलेक्ट्रोनिगेक्टिव एटम का नुकसान इलेक्ट्रॉनों और अधिक इलेक्ट्रोनिगेक्टिव परमाणु उन इलेक्ट्रॉनों को प्राप्त कर लेते हैं। इसलिए, परिणामस्वरूप प्रजातियां आंशिक रूप से आयनों का आरोप लगाते हैं और मजबूत इलेक्ट्रोस्टैटिक आकर्षण के कारण वे एक बंधन बनाते हैं।
-2 ->
आयोनिक बांड धातुओं और गैर-धातुओं के बीच बनते हैं। सामान्यतया, धातुओं में बाह्यतम गोला में कई सुराही इलेक्ट्रॉन नहीं होते हैं; हालांकि, ध्रुवता शेल में गैर-धातुएं आठ इलेक्ट्रानों के करीब हैं। इसलिए, गैर धातुओं को ओकटेट नियम को संतुष्ट करने के लिए इलेक्ट्रॉनों को स्वीकार करते हैं।आयनिक यौगिक का उदाहरण
ना + + सीएल - नाक्ल सोडियम (धातु) में केवल एक ही वैलिन्स इलेक्ट्रॉन और क्लोरीन (गैर धातु) है सात valence इलेक्ट्रॉनों
"ओकटेट नियम" को संतुष्ट करने के लिए दो या दो से अधिक परमाणुओं के बीच इलेक्ट्रॉनों को साझा करके सहसंयोजक यौगिकों का निर्माण होता है। यह बंधन प्रकार आमतौर पर गैर-धातु यौगिकों में पाया जाता है, आवधिक तालिका में एक ही परिसर या आस-पास के तत्वों के परमाणु। लगभग एक ही इलेक्ट्रो-ग्लेटिविटी मूल्य वाले दो परमाणुओं को उनके valence shell से (दान / प्राप्त) इलेक्ट्रॉनों का आदान-प्रदान नहीं होता है इसके बजाय, वे ओक्टेट कॉन्फ़िगरेशन हासिल करने के लिए इलेक्ट्रॉनों को साझा करते हैं।

मीथेन (सीएच 4), कार्बन मोनोऑक्साइड (सीओ), आयोडीन मॉनोबामाइड (आईबीआर)
सहसंयोजक बंधन
आयनिक और सहसंयोजक के बीच का अंतर क्या है यौगिकों? आयनिक यौगिकों और सहसंयोजक यौगिकों की परिभाषा आयनिक यौगिक: आयनिक यौगिक समीकरणों और आयनों का रासायनिक अवयव है जो एक जाली संरचना में आयनिक बंधनों द्वारा एक साथ आयोजित किया जाता है।
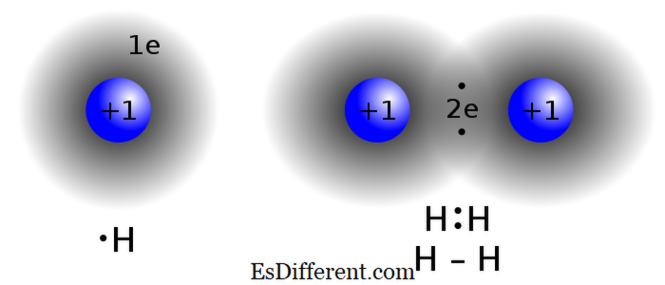
सहसंयोजक यौगिक:
कोवेलेंट कंपाउंड एक परमाणुओं के बीच एक या एक से अधिक इलेक्ट्रॉनों, विशेष रूप से इलेक्ट्रॉनों के जोड़े, के साझाकरण द्वारा गठित एक रासायनिक बांड है।
आयनिक और सहसंयोजक यौगिकों की संपत्ति
भौतिक गुण आयनिक यौगिकों:
सभी आयनिक यौगिकों के कमरे के तापमान पर ठोस रूप में मौजूद हैं आयनिक यौगिकों में एक स्थिर क्रिस्टल संरचना होती है। इसलिए, उनके पास पिघलने के बिंदु और उबलते बिंदु हैं। सकारात्मक और नकारात्मक आयनों के बीच आकर्षण की ताकत बहुत मजबूत है।
- अंतर
प्रकटन
पिघलने बिंदु
NaCl - सोडियम क्लोराइड
सफेद क्रिस्टलीय ठोस
801 डिग्री सेल्सियस| केएलएल - पोटेशियम क्लोराइड | सफेद या रंगहीन कांच का क्रिस्टल | 770 डिग्री सेल्सियस |
| एमजीएलएल | 2 | - मैगनीशियम क्लोराइड |
| सफेद या रंगहीन क्रिस्टलीय ठोस | 1412 डिग्री सेल्सियस | सहसंयोजक यौगिकों: सभी तीन रूपों में सहसंयोजक यौगिक मौजूद हैं; कमरे के तापमान पर ठोस, तरल पदार्थ और गैसों के रूप में |
| ईओण यौगिकों की तुलना में उनके पिघलने और उबलते अंक अपेक्षाकृत कम हैं। कोवेलेंट कंपाउंड प्रकटन | पिघलने बिंदु | एचसीएल-हाइड्रोजन क्लोराइड |
एक रंगहीन गैस
-114 2 ° सी
सीएच
| 4 | -मैथेन | एक रंगहीन गैस |
| -182 डिग्री सेल्सियस | सीसीएल | 4 |
| - कार्बन टेट्राक्लोराइड एक रंगहीन तरल < -23 डिग्री सेल्सियस चालकता | आयनिक यौगिकों: | ठोस आयनिक यौगिकों में मुफ्त इलेक्ट्रॉन नहीं होते हैं; इसलिए, वे ठोस रूप में बिजली नहीं करते हैं लेकिन, जब आयनिक यौगिकों को पानी में भंग कर दिया जाता है, तो वे एक ऐसा समाधान करते हैं जो बिजली का संचालन करता है। दूसरे शब्दों में, आयनिक यौगिकों के जलीय समाधान अच्छे विद्युत कंडक्टर होते हैं। |
| सहसंयोजक यौगिकों: न तो शुद्ध सहसंयोजक यौगिकों और न ही पानी में भंग प्रपत्र बिजली का संचालन नहीं करते हैं इसलिए, सहसंयोजक यौगिकों सभी चरणों में खराब विद्युत कंडक्टर हैं। सोल्युबिलिटी | आयनिक यौगिकों: | अधिकांश आयनिक यौगिकों पानी में घुलनशील हैं, लेकिन वे गैर-ध्रुवीय सॉल्वैंट्स में अघुलनशील हैं। |
सहसंयोजक यौगिकों:
अधिकांश सहसंयोजक यौगिक गैर-ध्रुवीय सॉल्वैंट्स में घुलनशील हैं, लेकिन पानी में नहीं। कठोरता
आयनिक यौगिकों: आयनिक ठोस कठिन और भंगुर यौगिक हैं
सहसंयोजक यौगिकों:
आम तौर पर, सहसंयोजक यौगिक आयोनिक ठोस पदार्थ से नरम होते हैं। छवि सौजन्य: जेसैक एफएच द्वारा "सहसंयोजित बंधन हाइड्रोजन" - खुद का काम। (सीसी बाय-एसए 3. 0) मार्क्स राइनशो द्वारा "आयनिकबंडिंग आरएच 11" - खुद का काम। (सीसी बाय-एसए 3. 0) विकिमीडिया कॉमन्स के माध्यम से



