अमोनियम नाइट्रेट और यूरिया के बीच का अंतर
अमोनियम नाइट्रेट बनाम यूरिया के लिए अत्यधिक आवश्यक तत्वों में से एक है नाइट्रोजन युक्त यौगिकों को आमतौर पर उर्वरकों के रूप में उपयोग किया जाता है क्योंकि नाइट्रोजन अत्यधिक आवश्यक तत्वों में से एक है पौधे वृद्धि और विकास अमोनियम नाइट्रेट और यूरिया ऐसे नाइट्रोजन युक्त ठोस पदार्थ हैं।
अमोनियम नाइट्रेट
अमोनियम नाइट्रेट में राष्ट्रीय राजमार्ग के रासायनिक सूत्र है
4 सं 3 यह अमोनिया का नाइट्रेट है, और इसकी निम्नलिखित संरचना है।
कमरे के तापमान और मानक दबाव में अमोनियम नाइट्रेट एक गंध रहित, सफेद क्रिस्टलीय ठोस के रूप में मौजूद है। यह लगभग 5 के पीएच वाला अम्लीय नमक है। 4. इसके दाढ़ द्रव्यमान 80. 052 ग्राम / मोल है। अमोनियम नाइट्रेट का पिघलने बिंदु लगभग 170 डिग्री सेल्सियस और लगभग 210
ओ सी के लिए गर्म होने पर यह विघटित हो जाता है। अमोनियम नाइट्रेट का मुख्य रूप से कृषि उद्देश्यों के लिए प्रयोग किया जाता है। यह नाइट्रोजन में समृद्ध है, इसलिए यह पौधों को नाइट्रोजन की आपूर्ति के लिए उर्वरक के रूप में उपयोग किया जाता है। चूंकि रासायनिक के साथ इसका सीधा संपर्क खतरनाक नहीं है और इसके बारे में विषाक्तता कम है, इसलिए यह उर्वरक के रूप में उपयोग करने के लिए फायदेमंद है। इसके अलावा, हीटिंग या प्रज्वलन अमोनियम नाइट्रेट विस्फोट के कारण होता है। इसलिए, यह विस्फोटकों में एक ऑक्सीकरण एजेंट के रूप में प्रयोग किया जाता है। इस विस्फोटक प्रकृति के कारण, जब अमोनियम नाइट्रेट भंडारण करते हैं तो हमें सावधान रहना चाहिए। अमोनियम नाइट्रेट स्थिर है, लेकिन जब यह विस्फोट के लिए पिघला हुआ राज्य के जोखिम में है तो वह अधिक है। अगर तेल, डीजल, कागज, चीर, या पुआल जैसे ऑक्सीडीज योग्य सामग्रियों के साथ संपर्क करने के लिए आता है तो जोखिम बढ़ जाता है। अमोनियम नाइट्रेट का उत्पादन एक सरल रासायनिक प्रतिक्रिया है। जब नाइट्रिक एसिड अमोनिया तरल के साथ प्रतिक्रिया व्यक्त की जाती है, तो समाधान फॉर्म में अमोनियम नाइट्रेट का उत्पादन होता है। औद्योगिक रूप से, नाइट्रिक एसिड और अमोनिया गैस का उपयोग उत्पादन के लिए किया जाता है। चूंकि यह एक अत्यधिक एक्सओथर्मिक और हिंसक प्रतिक्रिया है, इसलिए इसे बड़े पैमाने पर उत्पादन करने के लिए चुनौतीपूर्ण है। नमक होने के कारण, अमोनियम नाइट्रेट पानी में घुलनशील होता है। इसलिए, जब इसका इस्तेमाल किया जाता है तो उर्वरक को धोया जा सकता है और जल निकायों में जमा हो सकता है। यह जलीय जीवन के लिए एक घातक स्थिति हो सकती है -2 -> यूरिया
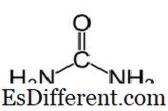
यूरिया में CO (NH2) 2 और निम्नलिखित संरचना का आणविक सूत्र है। यह कार्यात्मक समूह सी = हे के साथ कार्बामाइड है दो राष्ट्रीय राजमार्ग 2 समूह दो पक्षों से कार्बोनिल कार्बन से बंधे हैं। यूरिया प्राकृतिक रूप से नाइट्रोजन चयापचय में स्तनधारियों में निर्मित होता है। इसे यूरिया चक्र के रूप में जाना जाता है, और अमोनिया या अमीनो एसिड का ऑक्सीकरण हमारे शरीर के अंदर यूरिया का उत्पादन करता है। मूत्र के अधिकांश भाग मूत्र के साथ गुर्दे के माध्यम से उत्सर्जित होते हैं जबकि कुछ को पसीने से उत्सर्जित किया जाता है। शरीर से निकलने पर यूरिया की उच्च पानी विलेयता उपयोगी होती है। यूरिया एक बेरंग, गंधहीन ठोस है, और यह गैर विषैले है। चयापचयी उत्पाद होने के अलावा, इसका मुख्य उपयोग उर्वरक उत्पादन करना है।यूरिया उर्वरकों को रिहा करने वाले सबसे सामान्य नाइट्रोजन में से एक है, और इसमें अन्य ठोस नाइट्रोजन उर्वरक की तुलना में उच्च नाइट्रोजन सामग्री है। मिट्टी में, यूरिया को अमोनिया और कार्बन डाइऑक्साइड में परिवर्तित किया जाता है। यह अमोनिया मिटटी बैक्टीरिया द्वारा नाइट्राइट में परिवर्तित किया जा सकता है। इसके अलावा, यूरिया यूरिया नाइट्रेट जैसी विस्फोटक उत्पादन करने के लिए उपयोग किया जाता है। यह प्लास्टिक और चिपकने वाले जैसे रसायनों का उत्पादन करने के लिए कच्चे माल के रूप में भी प्रयोग किया जाता है।