1 एस और 2 एस कक्षा के बीच का अंतर | 1 एस बनाम 2 एस ऑर्बिटल
प्रमुख अंतर - 1 एस बनाम 2 एस ओर्बिटल
एटम मामले की सबसे छोटी इकाई है दूसरे शब्दों में, सभी पदार्थ परमाणुओं से बना है। एक परमाणु सबटामिक कण, मुख्यतः प्रोटॉन, इलेक्ट्रॉनों और न्यूट्रॉन से बना है। प्रोटॉन और इलेक्ट्रॉनों नाभिक बनाते हैं, जो परमाणु के केंद्र में स्थित है। लेकिन इलेक्ट्रॉन ऑरबिटल्स (या ऊर्जा स्तर) में तैनात हैं जो एक परमाणु के नाभिक के बाहर स्थित हैं। यह भी ध्यान रखना ज़रूरी है कि ऑर्बिटल्स काल्पनिक अवधारणा है जो कि परमाणु के सबसे संभावित स्थान को समझाने के लिए उपयोग किया जाता है। नाभिक के आसपास के विभिन्न ऑर्बिटल्स हैं उप-कक्षाएं भी हैं जैसे कि एस, पी, डी, एफ, आदि। उप-कक्षा कक्षा में गोलाकार होती है, जब इसे 3 डी संरचना के रूप में माना जाता है। न्यूक्लियस के चारों ओर एक इलेक्ट्रॉन की खोज करने की सबसे बड़ी संभावना है। ऊर्जा के स्तर के अनुसार एक उप कक्षीय को फिर से 1 एस, 2 एस, 3 एस, आदि के रूप में गिने जा रहा है। 1s और 2s कक्षा के बीच मुख्य अंतर प्रत्येक कक्षीय की ऊर्जा है। 1 एस कक्षा में 2 एस कक्षीय की तुलना में कम ऊर्जा होती है
सामग्री
1। अवलोकन और महत्वपूर्ण अंतर
2 1 एस ऑर्बिटल 3 क्या है 2 एस ऑर्बिटल
4 क्या है साइड तुलना द्वारा साइड - 1 एस बनाम 2 एस ऑर्बिटल
5 सारांश <1 1 एस कक्षीय क्या है?
1s कक्षीय कक्षीय कक्षीय है जो नाभिक के सबसे निकट है। अन्य ऑर्बिटल्स के बीच इसकी सबसे कम ऊर्जा है यह छोटी गोलाकार आकार भी है। इसलिए, कक्षीय कक्षीय का त्रिज्या छोटा है। ऑर्बिटल में केवल 2 इलेक्ट्रॉनों हो सकते हैं इलेक्ट्रॉन कॉन्फ़िगरेशन को 1s
1
के रूप में लिखा जा सकता है, यदि कक्षीय कक्ष में केवल एक इलेक्ट्रॉन है लेकिन अगर इलेक्ट्रॉनों की एक जोड़ी है, तो इसे 1 एस 2 के रूप में लिखा जा सकता है। फिर दो इलेक्ट्रॉनों के दो इलेक्ट्रॉनों के एक ही विद्युत प्रभार के कारण होने वाली प्रतिकर्षण के कारण विपरीत दिशा में कक्षाओं में चलने वाले दो इलेक्ट्रॉन। जब एक अनपेक्षित इलेक्ट्रॉन होता है, तो उसे सर्वोच्च-चुंबकीय कहा जाता है ऐसा इसलिए है क्योंकि यह चुंबक द्वारा आकर्षित किया जा सकता है लेकिन अगर कक्षीय भरे हुए हैं और इलेक्ट्रॉनों की एक जोड़ी मौजूद है, तो इलेक्ट्रॉनों को चुंबक द्वारा आकर्षित नहीं किया जा सकता; इसे डायैगनेटिक के रूप में जाना जाता है
-3 ->
चित्रा 01: 1 एस और 2 एस ओर्बिटल
1 एस और 2 एस ऑर्बिटल में क्या अंतर है?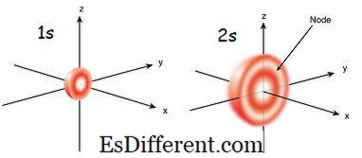
- तालिका से पहले अंतर आलेख ->
1 एस बनाम 2 एस ओर्बिटल
1s कक्षीय नाभिक के सबसे निकटतम कक्षीय है।
2 एस कक्षीय नाभिक के लिए दूसरा सबसे निकटतम कक्षा है। |
|
| ऊर्जा स्तर | 1s कक्षीय ऊर्जा 2 एस कक्षा की तुलना में अधिक है |
| 2 एस में अपेक्षाकृत कम ऊर्जा है | |
| कक्षा का त्रिज्या 1 एस कक्षा का त्रिज्या छोटा है। | 2 एस कक्षा का त्रिज्या अपेक्षाकृत बड़ा है। |
| ऑर्बिटल का आकार 1s कक्षीय में सबसे छोटी गोलाकार आकृति है | |
| 2 एस कक्षीय 1 एस कक्षीय से बड़ा है | इलेक्ट्रॉन भरना |
| इलेक्ट्रॉनों पहले 1s कक्षा में भरे हुए हैं | |
| 2 एस कक्षीय केवल 1 एस कक्षा में इलेक्ट्रॉनों के पूरा होने के बाद भर जाता है। | सारांश - 1 एस बनाम 2 एस ओर्बिटल |
| एक परमाणु एक 3 डी संरचना है जिसमें विभिन्न ऊर्जा स्तरों के विभिन्न आकार के ऑर्बिटल्स से घिरे केंद्र पर एक नाभिक होता है। ऊर्जा के मामूली अंतर के अनुसार इन ऑर्बिटल्स को फिर से उप-ऑर्बिटल्स में विभाजित किया गया है। इलेक्ट्रॉनों, जो एक परमाणु का एक प्रमुख उप-आट कण है, इन ऊर्जा स्तरों में स्थित है। 1 एस और 2 एस उप-ऑर्बिटल्स नाभिक के पास हैं 1s और 2s ऑर्बिटल्स के बीच मुख्य अंतर उनके ऊर्जा स्तर का अंतर है, जो कि 2s कक्षीय, 1s कक्षीय से उच्च ऊर्जा स्तर है। | |
| संदर्भ: | 1 Libretexts। "परमाणु ऑर्बिटल्स" "कैमिस्ट्री लिबर्टीटॉक्स लिब्रेटेक्स्ट्स, 03 नवम्बर 2015. वेब 26 मई 2017। |
2। परमाणु, इलेक्ट्रॉनों और ऑर्बिटल्स एन। पी।, एन घ। वेब। 26 मई 2017।
चित्र सौजन्य:
1 "एस ऑर्बिटल्स" (क्रॉप) सीके -12 फाउंडेशन द्वारा - फाइलः हाई स्कूल केमिस्ट्री। पीडीएफ, पृष्ठ 265 (सीसी बाय-एसए 3. 0) कॉमन्स के माध्यम से विकिमीडिया


