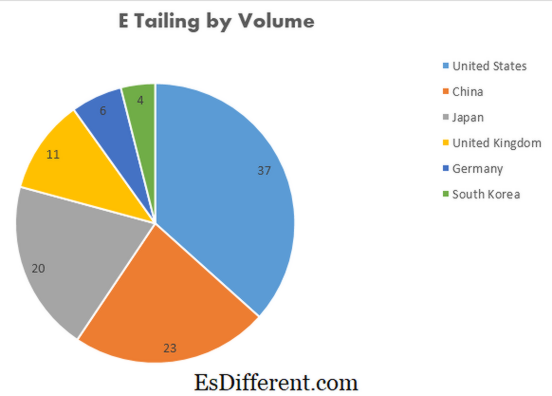
आंशिक दबाव और वाष्प दबाव के बीच का अंतर
आंशिक दबाव और वाष्प दबाव आमतौर पर इस्तेमाल किया जा सकता है सिस्टम घटकों द्वारा लगाए जाने वाले दबाव की मात्रा से संबंधित वैज्ञानिक शब्द, लेकिन उनकी पहचान दूसरों के लिए भ्रमित हो सकती है उनके प्रभाव और पहचान सहित इन शर्तों के बीच स्पष्ट अंतर है यह लेख इन शब्दों के बीच के अंतरों के बारे में अधिक विस्तार करेगा। इसमें इसके कुछ आवेदन भी शामिल करने के लिए कुछ उदाहरण भी शामिल होंगे I
हम वाष्प और आंशिक दबाव के बीच भेद को हल करने से पहले दबाव की अवधारणा को उजागर करके शुरू करते हैं। दबाव को वैज्ञानिक रूप से एक वस्तु या पदार्थ पर प्रति यूनिट क्षेत्र में लागू बल के रूप में परिभाषित किया जाता है। यह एक दूसरे पर टकराने वाले कणों द्वारा लागू बल के रूप में भी परिभाषित किया जा सकता है और इसे अक्सर पास्कल का उपयोग करके मापा जाता है कणों के टकराव के मामले में, गैस समीकरण और गैसों के गतिज सिद्धांत का इस्तेमाल दबाव की गणना के लिए किया जाता है।
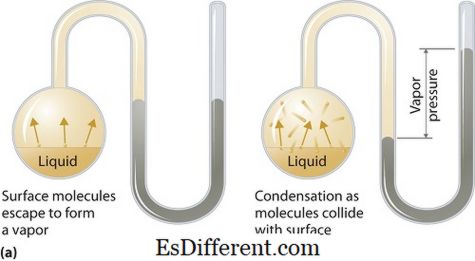
भाप का दबाव क्या है?
वाष्प का दबाव तरल या ठोस चरणों पर लागू हो सकता है जब वाष्प और तरल (ठोस) दोनों संपर्क में होते हैं तो एक बंद प्रणाली में दिए गए तापमान पर तरल या ठोस अवस्था में वाष्प द्वारा अपने तरल या ठोस अवस्था में वाष्प द्वारा दबाव डाला जाता है वाष्पीकरण के परिणामस्वरूप ये दबाव उत्पन्न होता है, जो ठोस या तरल पर बढ़ती गर्मी से सक्षम होता है। इस प्रकार वाष्पीकरण के उपाय के रूप में तापमान का उपयोग किया जाता है और यह वाष्प के दबाव के सीधे आनुपातिक होता है। इसका मतलब है, तापमान अधिक है वाष्प दबाव अधिक है।
-3 ->वाष्पीकरण के दौरान, हवा के अणु एक बंद तंत्र में उच्च गतिज ऊर्जा के कारण हवा में भाग लेते हैं। तब जब संतुलन में, वाष्प के दबाव और तरल (घन) के घनीभूत रूप के बीच वाष्प का दबाव उठता है। समाधानों में जहां अंतःक्रियाबल बल कमजोर हैं, वाष्प के दबाव में अधिक होने की संभावना होती है, और इसके विपरीत, समाधानों में जहां अंतर-मणिक बल मजबूत होते हैं, वाष्प दबाव कम होता है
वाष्प का दबाव आदर्श मिश्रण में भी हो सकता है जैसा कि राउल्ट के कानून द्वारा समझाया गया है। यह बताता है कि तरल या ठोस मिश्रण में किसी विशेष घटक के आंशिक भाप का दबाव उस घटक के वाष्प के दबाव के बराबर होता है जो उस मिश्रण के तिल अंश से गुणा किए गए तापमान पर देता है। नीचे दिए गए उदाहरण में यह स्पष्ट होगा।
उदाहरण 1।
0 का एक आदर्श मिश्रण को देखते हुए। 5 मॉल। इथेनॉल और 1. 5 मो। क्रमशः 30 केपीए और 52 केपीए के वाष्प दबाव के साथ मेथनॉल, प्रत्येक घटक के आंशिक वाष्प दबाव का निर्धारण करते हैं।
समाधान: < मॉल की कुल संख्या 1 है। 5 मील + 0। 5 मील = 2. 0 मील राऊल्ट के कानून के अनुसार, आंशिक वाष्प दबाव उस विशेष घटक के दाढ़ अंश से गुणा वाष्प के दबाव के बराबर होता है।इस मामले में, पी
मेथनॉल = 1. 5/2 * 52 = 39 केपीए और पी इथेनॉल = 0. 5/2 * 30 = 7. 5 केपीए जब आपके मिश्रण में घटकों के आंशिक वाष्प के दबाव होते हैं, तो आप उन्हें एक साथ जोड़कर कुल वाष्प दबाव प्राप्त कर सकते हैं। इस संबंध में, 7. 5 + 39 46. 5 केपीए इथेनॉल और मेथनॉल समाधान के मिश्रण का कुल वाष्प दबाव।
वाष्प के दबाव को प्रभावित करने वाले कारक
अणुओं की पहचान
जैसा कि पहले ही ऊपर उल्लेखित है, आणविक बलों के प्रकार वाष्प दबाव की मात्रा निर्धारित करते हैं। यदि बलों मजबूत हैं, तो कम वाष्प दबाव निकलता है, और यदि कमजोर है, तो अधिक भाप का दबाव उठता है। इसलिए, द्रव या ठोस की संरचना वाष्प के दबाव को प्रभावित करेगी।
तापमान
उच्च तापमान उच्च वाष्प दबाव की ओर जाता है क्योंकि यह आण्विक बल तोड़ने के लिए अधिक गतिज ऊर्जा को सक्रिय करता है ताकि अणुओं को तरल सतह से जल्दी से बच सकें। वाष्प के दबाव (संतृप्त वाष्प दबाव) बाहरी दबाव (वायुमंडलीय दबाव) के बराबर होता है, तरल को फोड़ा करना शुरू हो जाएगा। एक कम तापमान कम वाष्प के दबाव के साथ परिणाम होगा और यह तरल को फोड़ा करने के लिए समय लगेगा।
आंशिक दबावों के डाल्टन का कानून

आंशिक दबाव क्या है?
आंशिक दबाव का विचार पहले प्रसिद्ध वैज्ञानिक जॉन डाल्टन द्वारा प्रस्तावित किया गया था उसने आंशिक दबावों के अपने कानून को जन्म दिया जिसमें कहा गया है कि गैसों के आदर्श मिश्रण द्वारा लगाया जाने वाला कुल दबाव व्यक्तिगत गैसों के आंशिक दबावों के योग के बराबर है। कहें कि एक विशेष कंटेनर हाइड्रोजन, नाइट्रोजन और ऑक्सीजन गैसों से भरा है, कुल दबाव, पी
कुल, < ऑक्सीजन, नाइट्रोजन और हाइड्रोजन की मात्रा के बराबर होगा। उस मिश्रण के किसी भी गैस का आंशिक दबाव व्यक्तिगत गैस के दाढ़ अंश से कुल दबाव को गुणा करके गणना किया जाता है। संक्षेप में, आंशिक दबाव मिश्रण में किसी विशेष गैस द्वारा लगाया जाने वाला दबाव है, जैसे कि यह सिस्टम में अकेले काम कर रहा था। इस प्रकार आप किसी गैस के आंशिक दबाव का निर्धारण करते समय अन्य गैसों की उपेक्षा करते हैं। इस सिद्धांत को इंजेक्शन, 0 कहते हैं, 0.10 किलोग्राम में 2
एक सिद्धांत में सत्यापित किया जा सकता है। 0 लीटर कंटेनर को 230K पर और उसके बाद इंजेक्शन 0. 4 एटीएम एन 2 एक समान कंटेनर में एक ही तापमान पर एक ही आकार के, और फिर अंततः कुल दबाव को मापने के लिए गैसों को गठबंधन करते हैं; यह दो गैसों का योग होगा। यह स्पष्ट रूप से गैर-प्रतिक्रियाशील गैसों के मिश्रण में एक व्यक्तिगत गैस का आंशिक दबाव बताता है आंशिक दबाव की गणना करना आंशिक दबाव की गणना करने के लिए एक पूर्ण हवा है क्योंकि डाल्टन के कानून [1] इसके लिए प्रावधान प्रदान करता है यह प्रदान की गई विशिष्ट जानकारी पर निर्भर करेगा उदाहरण के लिए, उदाहरण के लिए, गैस ए और बी के मिश्रण के साथ-साथ गैस ए के दबाव के लिए कुल दबाव दिया जाता है, बी का आंशिक दबाव पी
कुल
= P का उपयोग करके गणना की जा सकती है एक + पी < बी शेष बीजीय जोड़तोड़ है I लेकिन ऐसे मामले में जहां मिश्रण का कुल दबाव दिया गया है, आप निर्धारित करने के लिए गैस बी के दाएं अंश का उपयोग कर सकते हैं, आंशिक दबाव है।द्विध्रुवी अंश, जिसे एक्स द्वारा दर्शाया गया है, गैस मिश्रण के कुल मॉल से गैस बी के मॉल को विभाजित करके पाया जा सकता है। उसके बाद आंशिक दबाव का पता लगाने के लिए, आप कुल दबाव से दाढ़ी अंश, एक्स को गुणा करेंगे। नीचे दिए गए उदाहरण में बताया गया है कि उदाहरण 2. नाइट्रोजन और ऑक्सीजन का मिश्रण, 2 के साथ। 5 मोल्स और 1. 85 मोल्स, क्रमशः 20. 20 लीटर कंटेनर में इंजेक्ट किए जाते हैं, जो 4 एटीएम के कुल दबाव के साथ होते हैं; ऑक्सीजन गैस द्वारा लगाए गए आंशिक दबाव की गणना समाधान:
मिश्रण में मॉल की कुल संख्या 2. 5 + 1 = 85 = 4. 35 moles है। तो आक्सीजन, एक्स < ओ < का दाढ़ अंश, 1 होगा। 85 moles / 4 35 मॉल = 0. 425 moles ऑक्सीजन का आंशिक दबाव 0 0 425 * 4 एटीएम = 1. 7 एटएम होगा। शेष गैस के आंशिक दबाव को उसी दृष्टिकोण के आधार पर गणना किया जा सकता है या ऑक्सिजन गैस का उपयोग करके और दल्टन के आंशिक दबाव के कानून के अनुसार कुल दबाव का अनुमान लगाया जा सकता है कि गैर-प्रतिक्रियाशील गैसों का कुल दबाव योग के बराबर है आंशिक दबाव।
वाष्प और आंशिक दबाव के बीच अंतर
उपरोक्त स्पष्टीकरण से, यह स्पष्ट है कि वाष्प दबाव और आंशिक दबाव दो अलग-अलग दबाव हैं वाष्प का दबाव तरल और ठोस चरणों पर लागू होता है जबकि आंशिक दबाव गैसीय चरण पर लागू होता है। चरण संक्रमण में वाष्प के दबाव को निष्पादित किया जाता है, ताकि पर्याप्त गर्मी को समाधान में जोड़ा जा सके, जिससे एक बंद तंत्र में भागने के लिए इसके अणुओं को आगे बढ़ाया जा सके।
आंशिक दबाव और वाष्प दबाव के बीच मुख्य अंतर यह है कि आंशिक दबाव एक मिश्रण में एक व्यक्तिगत गैस द्वारा लगाया जाने वाला दबाव होता है जैसे कि वह उस सिस्टम में अकेला होता है, जबकि भाप का दबाव वाष्प द्वारा दबाव में होता है द्रव या ठोस की घनीभूत अवस्था के साथ उष्मांकणीय संतुलन नीचे दी गई तालिका इन दबावों की एक संक्षिप्त तुलना देती है। वाष्प दबाव आंशिक दबाव
यह संतुलित या ठोस वाष्प द्वारा संतुलन में अपने कंडेनस चरण पर लगाया जाता है
यह गैर-प्रतिक्रियाशील गैस मिश्रण में व्यक्तिगत गैसों द्वारा लगाया जाता है
अच्छी तरह से राउल्ट की व्याख्या नियम