एसिटालडिहाइड और एसीटोन के बीच का अंतर | एसिटाडाडिहाइड बनाम एसीटोन
प्रमुख अंतर - एसिटालडिहाइड एसीटोन बनाम
एसिटालडिहाइड और एसीटोन दोनों ही छोटे कार्बनिक अणु होते हैं, लेकिन उनके कार्यात्मक समूहों के आधार पर उनके बीच एक अंतर होता है। दूसरे शब्दों में, वे विभिन्न रासायनिक और भौतिक गुणों के साथ दो अलग-अलग कार्बोनिल यौगिक हैं। एसीटोन केटोन समूह का सबसे छोटा सदस्य है, जबकि एसीटैल्डिहाइड एल्डिहाइड समूह का सबसे छोटा सदस्य है। महत्वपूर्ण अंतर एसिटालडिहाइड और एसीटोन के बीच संरचना में कार्बन परमाणुओं की संख्या; एसीटोन तीन कार्बन परमाणु है, लेकिन एसिटाडडाइहाइड केवल दो कार्बन परमाणु है कार्बन परमाणुओं की संख्या में अंतर और दो अलग-अलग कार्यात्मक समूहों के गुणों में कई अन्य मतभेद होते हैं।
एसीटोन क्या है?एसीटोन किटोन समूह का सबसे छोटा सदस्य है, जिसे
प्रोपोनोन के नाम से भी जाना जाता है। यह एक बेरंग, वाष्पशील, ज्वलनशील तरल है जो एक विलायक के रूप में उपयोग किया जाता है। अधिकांश कार्बनिक सॉल्वैंट्स पानी में भंग नहीं करते हैं, लेकिन एसीटोन पानी के साथ मिटाने योग्य है इसे प्रयोगशाला में सफाई उद्देश्यों के लिए और नेल पॉलिश हटानेवाला तरल पदार्थों में मुख्य सक्रिय संघटक के रूप में और पतले पेंट में इस्तेमाल किया जाता है।

एसिटालडिहाइड, जिसे
एथानल के नाम से भी जाना जाता है, एल्डिहाइड समूह का सबसे छोटा सदस्य है। यह एक रंगहीन, ज्वलनशील तरल है जो मजबूत घुटन गंध के साथ है। कई औद्योगिक उपयोग हैं जैसे एसिटिक एसिड, इत्र, ड्रग्स और कुछ फ्लेवर।
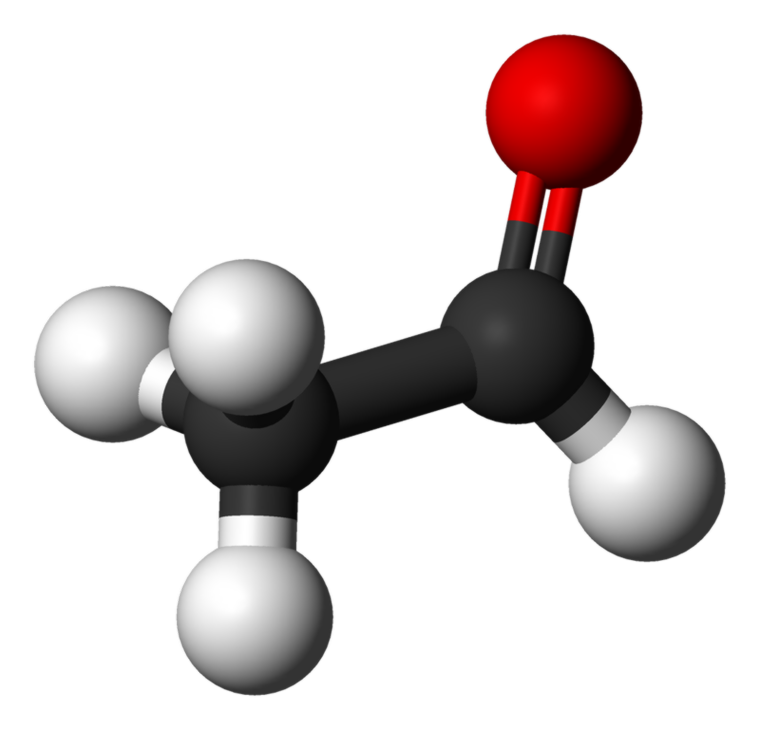
एसीटोन:
एसीटोन सी का आणविक सूत्र
3 एच 6 ओ यह केटोन परिवार का सरलतम सदस्य है यह एक तीखी गंध के साथ एक अस्थिर, ज्वलनशील तरल है। एसिटालडिहाइड: एसीटैल्डिहाइड सी का आणविक सूत्र सी 2 एच 4

ओ यह सबसे आसान और एल्डिहाइड परिवार के सबसे महत्वपूर्ण सदस्यों में से एक है यह कमरे के तापमान पर एक बेरंग, वाष्पशील, ज्वलनशील तरल है। एसिटालडिहाइड और एसीटोन की घटना एसीटोन: सामान्य तौर पर, एसीटोन मानव रक्त और मूत्र में मौजूद है यह सामान्य चयापचय के दौरान मानव शरीर में उत्पन्न और निपटारा भी है। जब लोगों को मधुमेह रोग होता है, तो यह मानव शरीर में बड़ी मात्रा में उत्पन्न होता है। एसिटालडिहाइड: एसिटालडिहाइड प्राकृतिक रूप से विभिन्न पौधों (कॉफी), रोटी, सब्जियों और परिपक्व फल में पाया जाता है।इसके अलावा, यह सिगरेट के धुएं, गैसोलीन और डीजल निकास में पाया जाता है। इसके अलावा, यह शराब के चयापचय में मध्यवर्ती है।

एसिटालडिहाइड और एसीटोन का उपयोग
एसीटोन: एसिटोन को मुख्य रूप से रासायनिक प्रयोगशालाओं में कार्बनिक विलायक के रूप में प्रयोग किया जाता है और रंग उद्योग में नेल पॉलिश हटानेवाला और पतले उत्पादन में सक्रिय एजेंट भी है।
एसिटालडिहाइड: एसीटोन का उपयोग एसिटिक एसिड, इत्र, रंग, स्वादिष्ट एजेंटों और दवाओं के निर्माण के लिए किया जाता है।
एसेडाल्डिहाइड और एसीटोन की विशेषताएं
पहचान एसीटोन:
एसीटोन आईोडोफॉर्म परीक्षण के लिए सकारात्मक परिणाम देता है। इसलिए, इसे आसानी से आइडाफॉर्म परीक्षण से एसिटाडाडिहाइड से विभेदित किया जा सकता है। एसिटालडिहाइड:
एसिटालडिहाइड, "टोलन के अभिकर्मक" के लिए चांदी का दर्पण देता है जबकि किटोन इस परीक्षण के लिए सकारात्मक परिणाम नहीं देते हैं। क्योंकि, यह आसानी से ऑक्सीकरण नहीं कर सकता क्रोएमिक एसिड टेस्ट और फाहलिंग की अभिकर्मक का उपयोग एसिटाडडिहाइड की पहचान के लिए भी किया जा सकता है।
प्रतिक्रियाशीलता
कार्बोनिल समूह (एल्डिहाइड और केटोन्स) की प्रतिक्रिया मुख्य रूप से कार्बोनिल (सी = हे) समूह के कारण होती है एसीटोन:
आम तौर पर, एल्किल समूह इलेक्ट्रॉन समूह दान कर रहे हैं एसीटोन में दो मिथाइल समूह हैं और कार्बोनिल समूह के ध्रुवीकरण को कम करते हैं। इसलिए, यह मिश्रित कम प्रतिक्रियाशील बनाता है कार्बोनिल समूह के दोनों किनारों से जुड़ी दो मिथाइल समूहों को भी अधिक स्टीयरिएक बाधा का कारण बनता है। इसलिए, एसीटोन एसीटैल्डिहाइड से कम प्रतिक्रियाशील है। एसिटालडिहाइड: इसके विपरीत, एसिटाडडाइहाइड में केवल एक मिथाइल समूह और कार्बन ब्लड से जुड़ा एक हाइड्रोजन परमाणु होता है। जैसा कि मिथाइल समूह इलेक्ट्रॉनों को दान करता है, हाइड्रोजन परमाणु इलेक्ट्रॉनों को वापस ले लेता है; यह अणु को अधिक ध्रुवीकृत बनाता है, और यह अणु को अधिक प्रतिक्रियाशील बनाता है। एसीटोन की तुलना में, एसिटाडाडिहाइड में कम स्टीयरिक प्रभाव होता है, और अन्य अणु आसानी से पहुंच सकते हैं। इन कारणों के कारण, एसीटैल्डिहाइड एसीटोन से अधिक प्रतिक्रियाशील है।




