मोनैटॉमिक और डायटोमिक के बीच का अंतर | Monatomic vs Diatomic
मोनैटमिक और डायटोमिक के बीच अंतर प्रजातियों में मौजूद परमाणुओं के संबंध में मुख्य रूप से है। जैसा कि नाम बताते हैं, इन दोनों शर्तों परमाणु संघों के विभिन्न राज्यों के लिए खड़ा है जहां 'मोनो' का अर्थ है 'एक' और 'डाय' का अर्थ है 'दो'। 'इसलिए, बस, मोनटेमिक का मतलब है एक'
एक परमाणु 'और डायटोमिक अर्थ' दो परमाणु ' हालांकि, इस बुनियादी परिभाषा में इतने भिन्न भिन्नताएं हो सकती हैं मौनाटिक क्या है?
जबएक एकल परमाणु अपने ही पर मौजूद है (जो कि शायद ही कभी मामला है), हम इसे मोनैटॉमिक कहते हैं इसका मतलब है कि तत्व उनके शुद्ध एकवचन रूप में हैं। इस श्रेणी के अंतर्गत आ सकता है जो एकमात्र व्यावहारिक उदाहरण होगा, वह महान गैस जो कि परमाणुओं के रूप में स्वयं के रूप में मौजूद होंगे क्योंकि उनके बाहरी शेल को इलेक्ट्रॉनों के एक ऑक्टेट के साथ पूरा किया गया है। इसलिए, वे और अधिक स्थिर होने के लिए किसी भी अधिक इलेक्ट्रॉनों को स्वीकार या दान नहीं करना चाहते हैं। इसलिए, महान गैस monatomic रूप में स्थिर हैं। कुछ उदाहरण निम्न हैं; वह - हीलियम, ने - नियॉन, अर - आर्गन, ज़ी - क्सीनन, क्र - क्रिप्टन, आरएन - रेडोन
-2 -> ईओनिक रूपों में विशेष रूप से समाधानों में एक परमाणु मौजूद है, और कुछ उदाहरण हैं; Na +, Ca2 +, K + आदि। इन आयनों पर एक निश्चित शुल्क होता है जिसका अर्थ है कि उनके पास एक स्थिरता है लेकिन, ऐसे अन्य प्रकार के आयन हैं जिनके पास कई सूजन हैं और कई आयनिक रूपों में मौजूद हैं, फिर भी मोनैटॉमिक हो रहे हैं। एक अच्छा उदाहरण आयरन है; Fe2 + और Fe3 + न केवल नब्ज (सकारात्मक रूप से चार्ज), लेकिन आयनों (नकारात्मक आरोप लगाए गए) मोनैटॉमिक रूप में भी मौजूद हैं; Cl-, F-, I- कुछ उदाहरण हैं ये ईओनिक प्रजातियां स्वयं पर स्थिर नहीं होती हैं और स्वाभाविक रूप से यौगिकों के रूप में समकक्षों की तलाश करती हैं। लेकिन, जैसा कि ऊपर उल्लेख किया गया है, वे उनके यौगिकों के जल निकास पर समाधान में पा सकते हैं। आयनिक प्रजाति शुद्ध रूप में एकल परमाणु की स्थिरता की कमी के कारण होती है जो महान गैस इलेक्ट्रॉनिक विन्यास को प्राप्त करने में असमर्थ है। इसलिए, स्थिरता प्राप्त करने के लिए ये परमाणु इलेक्ट्रॉनों को स्वीकार या दान करते हैं।
डायटोमिक क्या है?
जब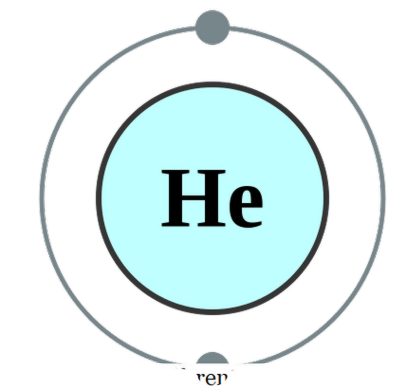
दो परमाणु एक दूसरे के साथ मिलकर हैं, तो हम इसे डायटोमिक कहते हैं ये परमाणु एक ही प्रकार या अलग से हो सकते हैं। जब वे दो समान परमाणुओं के संघ में होते हैं तो हम इसे '
होमोन्युलर डायाटॉम्स कहते हैं और यदि वे अलग-अलग प्रकार के बने होते हैं तो हम इसे'
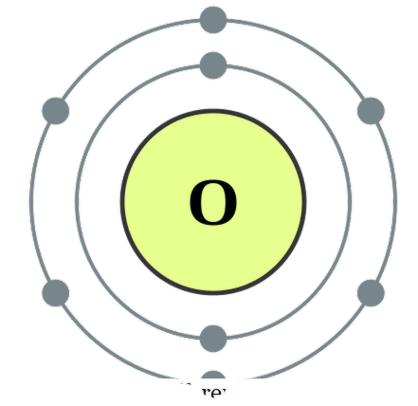
हेटरोन्यूक्लियर डाययाटम्स 'कहते हैं। कुछ होमोन्युलर डायाटम्स के उदाहरण ओ 2, एन 2, एच 2, आदि होंगे, जबकि सीओ, एनओ, एचसीएल आदि हेटरोन्यूक्लियर डायनाइट्स के उदाहरण के रूप में दिए जा सकते हैं। ऑक्सीजन डायटम को यौगिकों के रूप में माना जा सकता है क्योंकि ये एक दूसरे के साथ इलेक्ट्रॉनों को साझा करके अधिक स्थिरता प्राप्त करने के लिए इन संगठनों को बनाते हैं ताकि दोनों परमाणुओं को महान गैस इलेक्ट्रॉनिक विन्यास प्राप्त हो सके। वे परमाणु ऑर्बिटल्स के अतिव्यापी द्वारा सहसंयोजक बंधन के माध्यम से बंध सकते हैं या फिर वे उन में आयनिक बंधन बना सकते हैं जो एक सकारात्मक चार्ज प्रजातियों और एक नकारात्मक चार्ज प्रजातियों के बीच एक आकर्षण बल है। डायटोम्स के बीच सहसंयोजक बंध के उदाहरणों में सीओ, नो, आदि शामिल हैं और एचसीएल को ईओनिक आकर्षण चरित्र वाली प्रजाति के रूप में माना जा सकता है। हालांकि, क्योंकि एच + और सीएल के बीच आकर्षण बल बहुत मजबूत नहीं है, यह ईओण बांड के लिए एक बहुत अच्छा उदाहरण नहीं है जो एक और परिभाषित विषय है। मोनाटॉमिक और डायटोमिक के बीच अंतर क्या है? • मोनैटोमिक प्रजातियों में एक परमाणु होता है जबकि डायटोमिक प्रजातियों में दो परमाणु होते हैं। • मोनैटोमिक प्रजातियां सामान्य रूप से स्थिर नहीं होतीं, लेकिन डायटोमिक प्रजातियां आम तौर पर स्थिर होती हैं।
• नोबल गैसों केवल मोनटेमिक हैं और डायटोमिक रूप में नहीं पाए जाते हैं।
• डायनाटॉमिक प्रजातियों के बीच के रासायनिक बांड मौजूद होते हैं जबकि मोनैटमिक प्रजातियों में कोई बांड नहीं होता है।
छवियाँ सौजन्य:
पंबा से हीलियम इलेक्ट्रान कॉन्फ़िगरेशन (सीसी बाय-एसए 2. 0 यूके)
डीपीईपी द्वारा ऑक्सीजन इलेक्ट्रॉन विन्यास (सीसी बाय-एसए 3. 0)